- Chi siamo
-
-
-

- Chi siamoUna Fondazione fatta di persone.
-
-
-
- Cosa facciamo
- Sostienici
Novembre è il mese dedicato alla prevenzione al maschile: alla Fondazione Piemontese per la Ricerca sul Cancro ci impegniamo, ogni giorno, a sostenere i ricercatori e medici dell’Istituto di Candiolo – IRCCS, nella ricerca e cura del tumore alla prostata. La nostra ricerca, portata avanti con dedizione e innovazione, ha già consentito a migliaia di uomini di vivere una vita più serena e consapevole.
Per te una guida completa e gratuita da consultare con all’interno le più efficaci attività di diagnosi e di cura del tumore alla prostata, per conoscere più da vicino un argomento che per tanti uomini spesso è tabù.

Dottor Enrico Checcucci, Urologo e Coordinatore del Gruppo Interdisciplinare Cure Neoplasie Urologiche
In questa guida troverai informazioni su: diagnosi, grading, prognosi, terapia.
Per la diagnosi di carcinoma della prostata è necessario percorrere varie tappe, che portano prima al sospetto e poi alla certezza della patologia.
La presenza dei fattori di rischio sopraelencati può già fornire un certo sospetto di patologia prostatica.
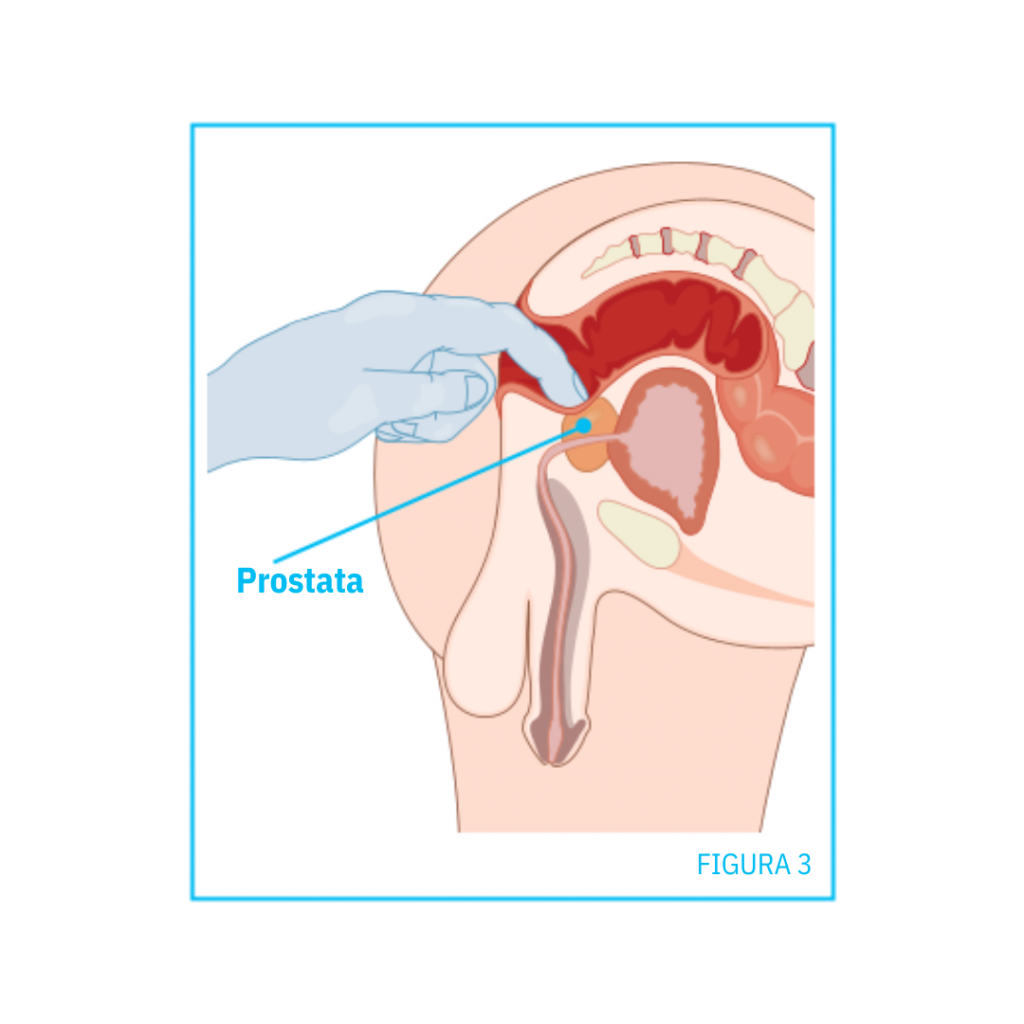
Intanto è utile procedere ad una esplorazione rettale da parte del medico, attraverso la quale può verificare la presenza di un eventuale nodulo a livello della ghiandola prostatica.
Quest’indagine è molto importante dal punto di vista della prevenzione in quanto, sebbene possa talvolta essere spiacevole, permette di fare una rapida verifica che può portare alla individuazione del tumore: più è precoce la diagnosi, maggiore è l’aspettativa di vita della persona. Contestualmente di grande importanza è il dosaggio del PSA.
I livelli di PSA hanno normalmente hanno valori compresi tra 0 e 4 ng/ml, e possono aumentare nei processi patologici fino a valori superiori a 10 ng/ml.
Per valori inferiori ai 4 ng/ml vi è una probabilità del 5% della presenza di carcinoma; per i valori compresi tra 4 e 10 la percentuale sale al 25%, fino ad arrivare al 55% in presenza di valori maggiori di 10 ng/ml. Per migliorare l’affidabilità dei valori di PSA (quando superi 4 ng/ml) possono essere richiesti altri tre parametri:
Le indagini di radiologia diagnostica a seguire sono:
• Ecografia sovrapubica o, meglio, transrettale (vedi immagine), che permette di indagare anche la zona centrale della prostata;
• Risonanza Magnetica multiparametrica che permette una indagine della prostata con particolare riguardo al tumore ed alla integrità della capsula prostatica;
• TAC per ricercare le metastasi ossee.
Durante il percorso diagnostico-terapeutico è possibile che al paziente venga richiesto di effettuare una indagine di medicina nucleare, essenzialmente la scintigrafia ossea globale corporea e/o la PET/TC con colina.
Tutte le indagini di medicina nucleare prevedono la somministrazione endovenosa di una piccola quantità di radiofarmaco che, una volta distribuitasi all’interno dell’organismo, permette di ottenere delle immagini diagnostiche che possono fornire importanti informazioni ai fini del più corretto approccio terapeutico alla malattia.
I radiofarmaci non sono mezzi di contrasto, non sono pericolosi, esponendo i pazienti ad una debole radioattività per brevi periodi di tempo.
La scintigrafia ossea può essere utilizzata nella fase di stadiazione iniziale, prima o dopo l’intervento chirurgico e può essere ripetuta nel tempo, specie quando siano presenti sintomi suggestivi per la presenza di localizzazioni scheletriche di malattia o quando altre indagini radiologiche pongono in evidenza alterazioni dell’osso sospette per secondarietà.
La PET/TC è un’altra indagine di medicina nucleare ampiamente utilizzata in ambito oncologico per lo studio di diverse tipologie di tumori. Il radiofarmaco maggiormente utilizzato per lo studio del tumore prostatico è rappresentato dalla colina, marcata con un isotopo radioattivo, che permette di valutare il metabolismo delle cellule tumorali.
La PET/TC con colina non è richiesta di routine per tutti i pazienti con tumore prostatico: l’indicazione principale è data da un progressivo incremento dei valori di PSA, in assenza di evidenza clinica o strumentale di recidiva/localizzazioni della malattia di base.
La diagnosi di certezza è data esclusivamente dalla biopsia, che viene fatta solo in presenza di PSA > 4 ng/ml, rilevazione di nodulo all’esplorazione rettale e reperto ecografico indicativo.
La biopsia consiste nell’asportazione di un pezzetto di tessuto dal nodulo sospetto e sua successiva analisi anatomo-patologica.
Attraverso la valutazione del campione di tessuto prelevato tramite la biopsia si ricava il Gleason Score (GS).
Nell’analisi delle due diverse aree maggiormente estese all’interno del campione, l’anatomopatologo assegna a ciascuna di esse un punteggio tra 1 e 5 dove 1 indica la presenza di cellule ben differenziate, quindi a scarsa malignità, mentre 5 indica la presenza di cellule indifferenziate ad elevata malignità.
Il Gleason Score non è altro che la somma dei due valori, e sarà quindi compreso tra 2 e 10; questo punteggio determina la malignità complessiva del tessuto tumorale.
Più recenti Linee Guida (ISUP 2015) considerano 5 gradi di aggressività, che raggruppano i precentri Gleason score:
Per la classificazione in classi di rischio vanno considerati 3 parametri:
I pazienti possono quindi, sommando le varie caratteristiche mediante formule dette nomogrammi, essere suddivisi in tre gruppi di rischio: a basso rischio, a rischio intermedio e ad alto rischio così da modulare la terapia in maniera adeguata al livello di rischio del paziente stesso.
Un nomogramma è una rappresentazione grafica di una funzione matematica con più variabili e nel caso specifico nostro misura la probabilità di efficacia di un trattamento (chirurgia o radioterapia) sulla base delle caratteristiche del tumore (stadiazione clinica, GS e PSA).
Per quanto concerne la chirurgia esistono numerosi nomogrammi il primo dei quali e che resta il più importante è quello di Partin; esso è stato recentemente aggiornato. PartinTables 2013: predizione tra stadio clinico e patologico (Johns Hopkins RP patients 2006–2011).
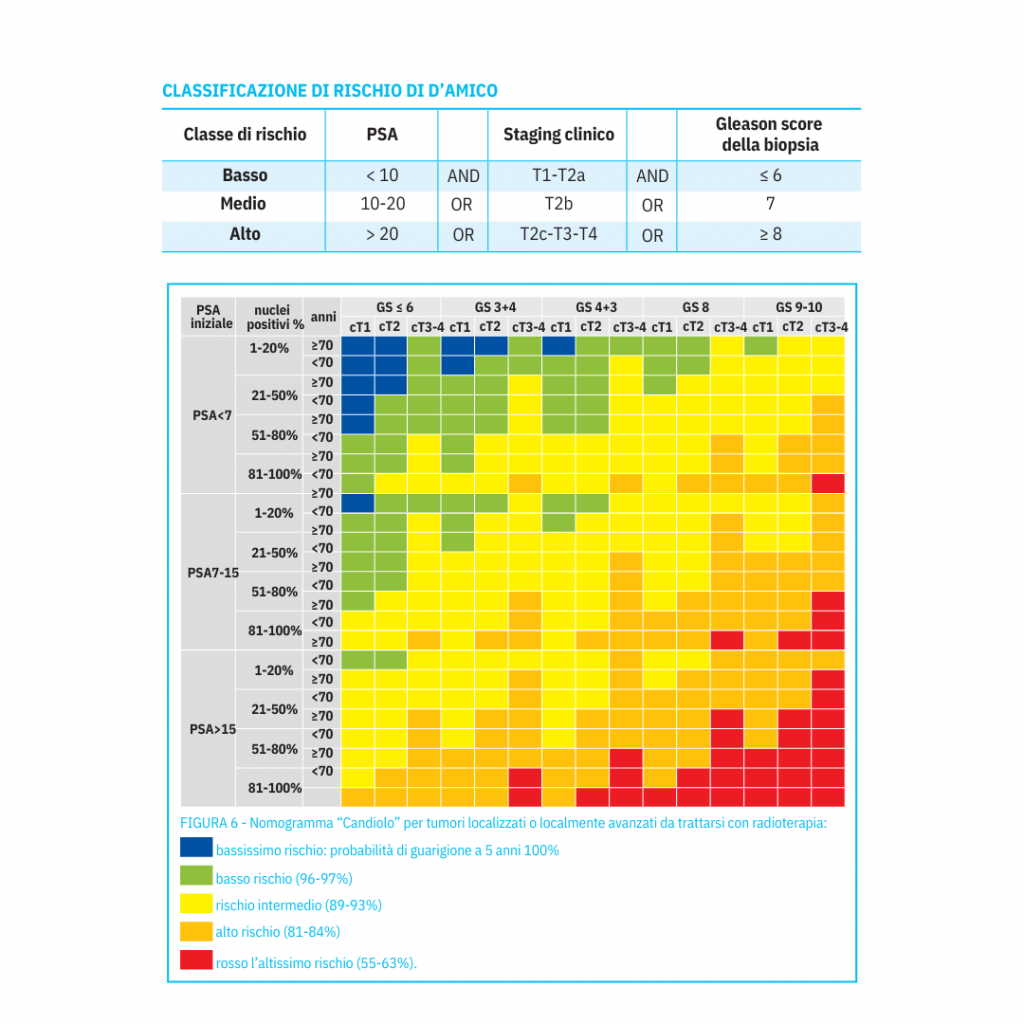
Anche per la radioterapia esistono nomogrammi tra cui il più utilizzato è quello di d’Amico che utilizza i tre classici parametri (PSA, GS e stadio clinico) al fine di dividere i pazienti in tre gruppi di rischio.
Più di recente, grazie all’analisi dei dati di un’ampia casistica di pazienti trattati con radioterapia nel nord Italia, ed in particolare in Piemonte, è stato proposto un nomogramma che divide i tumori prostatici da sottoporre a radioterapia, in 5 classi e cioè in bassissimo rischio, basso rischio, rischio intermedio, alto rischio ed altissimo rischio tenendo conto anche della età e del carico tumorale (5,6).
L’aspettativa di vita dei soggetti affetti da carcinoma prostatico è strettamente legata ai valori di PSA, alla stadiazione TNM (che valuta la dimensione e la presenza di metastasi a linfonodi e altri tessuti) e al Gleason Score.
È quindi necessario che vengano valutati tutti e tre questi parametri per poter fornire una qualsiasi stima sulla sopravvivenza del soggetto.
In generale in presenza di malattia in fase iniziale cioè in pazienti a basso rischio la percentuale (tasso) di guarigione è molto elevata arrivando a valori del 98-100% a 5 anni ed a valori del 96-99% a 10 anni; per tumori in stadio intermedio cioè in pazienti a rischio intermedio la percentuale di guarigione a 5 e 10 anni varia dal 90 all’85% mentre per pazienti ad alto rischio la percentuale di guarigione scende a valori del 65-50%; quando invece la malattia viene diagnosticata in fase già metastatica il tasso di sopravvivenza a 5 anni può scendere attorno al 20%.
Sì esistono e ce ne sono molte, tra le quali le principali sono la chirurgia, la radioterapia e la terapia medica. Esse possono essere impiegate singolarmente od anche in associazione tra loro. La terapia dipende essenzialmente da quattro fattori:
Le varie possibilità terapeutiche sono quindi rivolte alle più varie presentazioni del tumore in pazienti di differenti età e condizioni generali.
Esistono numerose linee guida sulla terapia del cancro prostatico. Le più seguite sono le seguenti:
Tutte le linee guida riflettono lo stato dell’arte della letteratura ma sono viste da angolazioni proprie della specialità che le promuove.
In ogni caso le indicazioni alla terapia dovrebbero essere discusse in maniera collegiale tra chirurgo urologo e radioterapista e possibilmente anche con l’oncologo medico.
In queste riunioni, dette anche visite collegiali o GIC (Gruppi Interdisciplinari Cure), in presenza del paziente, vengono presentate allo stesso le opzioni terapeutiche con vantaggi e svantaggi di ognuna e l’opzione suggerita dai curanti in modo che il paziente sia in grado di prendere la sua decisione.
Alle tre figure possono aggiungersi, per casi selezionati, il radiologo, il medico nucleare ed il patologo; dovrebbe essere presente anche la figura infermieristica di supporto.
Alla fine della discussione tra i vari specialisti viene presentata al paziente la terapia che i medici ritengono ideale per il suo caso; se vi sono più terapie vengono discussi con lui vantaggi e svantaggi dei diversi approcci; da questo momento il paziente è in grado di aderire al programma proposto o di scegliere tra le diverse opzioni.
“Wait and watch”: nel caso di pazienti molto anziani e con importanti comorbidità, se affetti da carcinomi a bassa-intermedia malignità è possibile non fare alcuna terapia in quanto si andrebbe ad accorciare l’aspettativa di vita del paziente più di quanto lo farebbe il tumore stesso; talvolta la proposta di non trattamento arriva dal paziente stesso e talvolta dal medico curante
Sorveglianza attiva: in caso di pazienti con carcinomi a basso rischio e con basso carico (cosiddetti tumori indolenti) è possibile controllare l’evoluzione del tumore senza intervenire, facendo dosaggi frequenti del PSA (in media ogni 3-4 mesi) , e ripetendo biopsia e/o RM a scadenze predefinite; si tratta di un protocollo da condividere con il paziente che si impegna a rispettarlo scrupolosamente; in caso di evoluzione del tumore si passa ad un trattamento radicale cioè a chirurgia o a radioterapia.
In Europa ed in Italia sono in corso numerosi studi sulla sorveglianza attiva; uno studio della rete oncologica piemontese (studio START) ha ormai arruolato centinaia di pazienti.
Intervento chirurgico cioè Prostatectomia radicale: è stato il primo approccio radicale nel trattamento del carcinoma della prostata sin dagli anni ’70 dello scorso secolo; chiamata anche prostato-vesciculectomia radicale è indicata per tumori localizzati (sino al T2c e, in casi selezionati anche in stadi più avanzati) ed è considerata una delle due procedure di elezione. Si tratta di una procedura che permette di asportare tutta la ghiandola prostatica assieme alle vescicole seminali tramite vari approcci:
Inoltre la chirurgia permette la asportazione dei linfonodi delle stazioni linfatiche (linfadenectomia) in cui drena la prostata e che potrebbero essere intaccati dalla malattia.
La chirurgia può avere effetti avversi essendo gravata da un rischio, seppur piccolo, di incontinenza urinaria e un po’ maggio- re di impotenza. In caso di resezione incompleta (margini positivi) è indicata una radioterapia postoperatoria.
L’intervento prevede la messa in situ di un catetere vescicale che in genere viene tolto prima della dimissione del paziente. La chirurgia viene praticata in regime di ricovero, che attualmente tende a ridursi entro una settimana circa.
Radioterapia: è la vera alternativa alla chirurgia utilizzata in caso di tumori localizzati ma anche nel caso di tumori localmente avanzati; in passato, sino a circa 15-20 anni orsono, essa veniva utilizzata nei pazienti in cui non si poteva procedere alla chirurgia o che rifiutavano l’approccio chirurgico; attualmente i risultati della Radioterapia sono assolutamente uguali a quelli della chirurgia come dimostrato da un recente studio inglese pubblicato su una delle più importanti riviste mediche internazionali.
La Radioterapia può essere effettuata mediante un approccio interno cioè con brachiterapia con impianto di una sorgente radioattiva permanente (semi di Iodio 125 o di palladio 103 a bassa energia o temporanea con Iridio 192 ad alta energia) oppure con un approccio esterno mediante radiazioni ad alta energia cioè con Radioterapia conformazionale(3DCRT) che è lo standard internazionale minimo o meglio con Radioterapia ad Intensità modulata (IMRT), nuovo standard internazionale. La possibilità di un controllo mediante immagini (IGRT) la rende più sicura ed efficace. La radioterapia esterna viene effettuata mediante acceleratori lineari (vedi Figura 9b) oppure mediante macchine dedicate, ad esempio la Tomoterapia (vedi Figura 9a).
Il trattamento con radioterapia può avere effetti avversi essendo gravato da effetti collaterali acuti quali fastidi a livello del retto e aumento della peristalsi intestinale, irritazione della regione anale, cistite e da un rischio tardivo, seppur piccolo, di uretrite per quanto concerne la brachiterapia o di danno rettale per quanto attiene la radioterapia esterna.
La radioterapia esterna viene praticata in regime ambulatoriale e la sua durata varia classicamente da 6 a 8 settimane; più recentementesono state messe a punto tecniche di radioterapia ipofrazionate la cui durata varia da 5 a 6 settimane sino a giungere, solo per casi estremamente selezionati, ad una radioterapia con alte dosi concentrate in poco tempo (ipofrazionamento spinto), ad esempio in una settimana, grazie all’impiego di una tecnica stereotassica, che si può attuare sia con acceleratori lineari oppure con macchine dedicate come ad esempio il Cyberknife.
Terapia ormonale: Il testosterone, l’ormone sessuale maschile prodotto principalmente dai testicoli, influisce sulla crescita del cancro della prostata. Abbassando il livello di testosterone in circolo, è possibile rallentare o anche bloccare la crescita delle cellule tumorali e ridurre le dimen- sioni del tumore.
Il livello di testosterone può essere ridotto con la somministrazione di farmaci simili agli ormoni prodotti dall’organismo.
L’ormonoterapia può essere utilizzata per controllare la malattia in stadio avanzato o metastatico e dopo chirurgia o radioterapia se il livello di PSA continua ad aumentare oppure per prevenire la ripresa della malattia se i linfonodi risultano invasi o in combinazione con la radioterapia nei tumori a rischio intermedio-alto. I farmaci utilizzati si distinguono in funzione del meccanismo d’azione e sono:
L’ormonoterapia può essere somministrata prima, durante o dopo chirurgia, radioterapia o brachiterapia rispettivamente come neoadiuvante, concomitante e adiuvante. Per valutare la risposta all’ormonoterapia è necessario sottoporsi a visite di controllo e ripetere il test del PSA ogni 3-4 mesi e potrebbe essere necessario sottoporsi a esami radiologici (radiografie mirate, scintigrafia ossea, PET, RMN).
L’ormonoterapia utilizzata in modo continuativo per lunghi periodi può diminuire il suo effetto terapeutico di controllo della malattia. Il primo segnale è l’aumento costante del PSA.
Al fallimento dell’ormonoterapia si può tentare un altro trattamento ormonale o chemioterapico.
Recentemente sono stati introdotti due trattamenti ormonali che attualmente si utilizzano nella fase metastatica della malattia: abiraterone ed enzalutamide. Abiraterone agisce bloccando la produzione del testosterone da parte delle ghiandole surrenaliche, mentre enzalutamide è un farmaco che inibisce l’attività del recettore per gli androgeni.
Gli effetti collaterali dell’ormonoterapia più frequenti sono vampate di calore, aumento di peso, disturbi del tono dell’umore, osteoporosi, perdita della libido e disfunzione erettile.
Alcuni preparati ormonali (flutamide e bicalutamide) tendono a ingrossare le mammelle, creando un senso di tensione, a volte dolorosa. Gli effetti collaterali possono compromettere la qualità di vita dei pazienti in modo significativo: per ridurre gli effetti collaterali della terapia alcuni specialisti adottano una modalità di somministrazione intermittente, cioè somministrano il trattamento per un certo periodo, lo sospendono al riscontro di un abbassamento del PSA e lo riprendono quando questo aumenta di nuovo.
Chemioterapia: è riservata in genere ai pazienti che non rispondono più alla terapia ormonale e serve a migliorare i sintomi di cui soffrono i pazienti stessi. La chemioterapia viene in genere praticata in regime di Day-hospital ma, in casi particolari, necessita di ricovero del paziente. Il farmaco più impiegato è il Docetaxel.
HIFU (High Intensity Focused Ultrasound): è un trattamento che utilizza fasci focalizzati di ultra- suoni (FIGURA 9A); è utilizzato in genere in alternativa alla chirurgia o alla radioterapia in pazienti anziani ma non è uno standard; meglio quando viene utilizzato come terapia di salvataggio dopo recidive post-radioterapia visibili alla risonanza magnetica (FIGURA 9B). In genere la terapia con HIFU viene praticata nelle recidive dopo radioterapia. Il trattamento mediante HIFU necessita di una notte di ospedalizzazione.
Crioterapia: si effettua attraverso aghi inseriti direttamente nel tumore collegati ad un criostato, cioè ad un generatore del freddo, viene iniettato gas Argon, che congela il tumore trasformandolo in una palla di ghiaccio; la procedura viene ripetuta a pochi muniti di distanza e determina la morte sia della cellule tumorali che dei vasi che nutrono il tumore; la palla di ghiaccio viene poi scongelata mediante gas Elio; la crioterapia rappresenta l’unica ablazione la cui estensione è monitorizzabile in tempo reale sotto guida TC o RM. È un trattamento utilizzato in genere come terapia di salvataggio.
9. RITA (Radiofrequency Interstitia lTumor Ablation): più impiegata nel trattamento dei tumori renali men- tre nel campo dei tumori della prostata è una metodica sperimentale con ancora pochi dati al suo attivo.
10. Microonde interstiziali: anche questa tecnica ha al momento pochi risultati in letteratura.
11. Ipertermia a microonde: si tratta di una tecnica che impiega le microonde per generare un calore moderato (41-42.5°C) come radiosensibilizzante della radioterapia a dosi subottimali in quanto in sede già precedentemente radiotrattata od operata. Da poche équipes nel mondo viene impiegata anche come radiosensibilizzante nel trattamento radicale dei casi localmente avanzati.
Qui di seguito si trovano i redattori della guida cartacea da cui sono stati tratti i materiali per la versione online: